
本制品是一种通过高质量的重组Protein A+G磁珠,配合用户自备的特异性抗体,进行目的蛋白免疫沉淀或免疫共沉淀的试剂盒。本制品的免疫沉淀产物,可以用于目的蛋白或其蛋白复合物组分的检测。
本试剂盒包含高质量的Protein A+G磁珠及经过优化验证的免疫沉淀必要试剂,使免疫沉淀(IP,也称Pull-down)或免疫共沉淀(Co-IP)实验更加简单、便捷、高效,配合特异性抗体,广泛用于目的蛋白或其蛋白复合物的免疫沉淀、免疫共沉淀或纯化等实验。
本试剂盒中的重组Protein A和Protein G可与多数哺乳动物IgG的Fc端特异性结合,分子量均约为25kDa。该重组Protein A和Protein G通过改造,仅保留了与IgG Fc端结合相关的氨基酸序列,去除了结合位点以外可能导致非特异性结合的序列,从而可以有效减少非特异性结合。本制品的每个Protein A和Protein G分子分别可以结合5和3个IgG分子。
本试剂盒包含高质量的BalbMag Protein A+G磁珠、正常小鼠IgG和兔IgG(作为阴性对照)及优化的各种缓冲液如Lysis Buffer、10×TBS、100×Protease Inhibitor Cocktail、Acid Elution Buffer、Neutralization Buffer、5×SDS-PAGE Sample Loading Buffer等免疫沉淀必要试剂,使免疫沉淀或免疫共沉淀实验更加简单、便捷、高效。本试剂盒进行免疫沉淀的流程参考图1。BalbMag Protein A+G磁珠经适当洗涤后,加入一定量特异性抗体,Protein A+G可与抗体Fc端特异性结合,一定时间孵育后形成Protein A+G磁珠-抗体混合物(beads-Ab complex),然后加入样品,样品可被抗体的Fab端特异性识别而形成Protein A+G磁珠-抗体-抗原免疫复合物。洗涤免疫复合物以去除未结合的蛋白,然后使用酸性洗脱液或SDS-PAGE上样缓冲液等方法从磁珠上洗脱结合的免疫复合物用于后续检测。

| 组分 | 100T | 500T |
| Lysis Buffer | 50mL | 250mL |
| 10×TBS | 10mL | 30mL |
| 100×Protease Inhibitor Cocktail | 0.5mL | 2.5mL |
| BalbMag Protein A+G Magnetic Beads | 0.4mL | 2mL |
| Normal Mouse IgG (1mg/mL) | 10μL | 50μL |
| Normal Rabbit IgG (1mg/mL) | 10μL | 50μL |
| Acid Elution Buffer | 2mL | 10mL |
| Neutralization Buffer | 0.2mL | 1mL |
| 5×SDS-PAGE Sample Loading Buffer | 0.4mL | 2mL |
保存:-20℃,有效期一年。BalbMag Protein A+G Magnetic Beads可以4℃保存。

对于常规的免疫沉淀实验,按照每100μL样品使用4μL磁珠悬浊液,本试剂盒小包装和中包装分别可以进行100次和500次样品的免疫沉淀,同时分别可以进行20个和100个阴性对照的免疫沉淀;按照每500μL样品使用20μL磁珠悬浊液,则分别可以进行20次和100次样品的免疫沉淀,同时分别可以进行4个和20个阴性对照的免疫沉淀。

免疫沉淀或免疫共沉淀是研究蛋白或蛋白与蛋白相互作用(PPIs)的常用实验技术,通过使用特异性抗体和可结合抗体的介质(如Protein A/G Agarose或磁珠),或直接使用偶联特异性抗体的介质(如琼脂糖凝胶或磁珠),然后通过离心或磁力从溶液中分离出抗原和抗体复合物,从而将目标蛋白质从复杂样品中分离出来,随后可以用于Western印迹检测或质谱分析等。
Protein A是一种发现于金黄色葡萄球菌的细胞壁表面蛋白,分子量为42kDa;Protein G是C型或G型链球菌表达的免疫球蛋白结合蛋白。Protein A和Protein G功能相似,能特异性地与哺乳动物免疫球蛋白结合,结合的部位通常为免疫球蛋白的Fc区,但有资料显示Protein A也会和人VH3家族的Fab区结合,而Protein G有时与Fab区也有一定结合。同时,两者对于不同的免疫球蛋白亚类的结合能力有所不同。适当重组改造的Protein A、G与磁珠以一定的方式结合,可用于免疫沉淀或抗体的纯化。

本试剂盒中的BalbMag Protein A+G磁珠,也被称为Protein A+G Magnetic Beads,可以特异性地结合相关抗体,并可以借助磁力架等磁分离设备非常便捷地应用于目的蛋白或其蛋白复合物的免疫沉淀或纯化等实验。
- BalbMag Protein A+G磁珠的特点:
- 特异性强、靶蛋白结合量高,磁珠含量达10mg/mL:
传统的Protein A+G琼脂糖凝胶孔径大,容易产生非特异吸附,而本制品磁珠粒径小,不易产生非特异吸附。本制品每毫升 磁珠悬浊液含约10mg磁珠,由Protein A磁珠和Protein G磁珠按1:1比例混合而成,含有不少于0.6mg重组Protein A、Protein G,通常可结合不少于0.7mg人IgG (具体的最大结合量和抗体类型及目的蛋白等相关)。每500μL样品,通常仅需使用10~20μL磁珠悬浊液,就可以高效地进行免疫沉淀实验。 - 本制品结合抗体或抗体复合物的速度快:本制品所使用的纳米级磁珠(~200nm)具有超大比表面积,便于磁珠与抗体或抗体复合物的快速有效结合。通常10分钟内即可完成抗体或其复合物的吸附的过程,30分钟内完成目的蛋白免疫沉淀操作。缩短操作时间可以有效避免在长时间操作过程中目的蛋白的降解或变性,充分保证目的蛋白的活性。由于采用磁性分离,每次进行IP和Co-IP相比于琼脂糖凝胶可以节省40%的时间。
- 特异性强、靶蛋白结合量高,磁珠含量达10mg/mL:
- BalbMag Protein A+G磁珠的主要指标:
磁珠浓度 10mg/mL 磁珠粒径 ~200nm 磁珠磁性 超顺磁性 偶联蛋白 重组Protein A和Protein G 蛋白分子量 ~25kDa (Protein A and Protein G) 结合能力 ≥ 0.7mg人IgG/mL磁珠 应用 IP,Co-IP,蛋白纯化

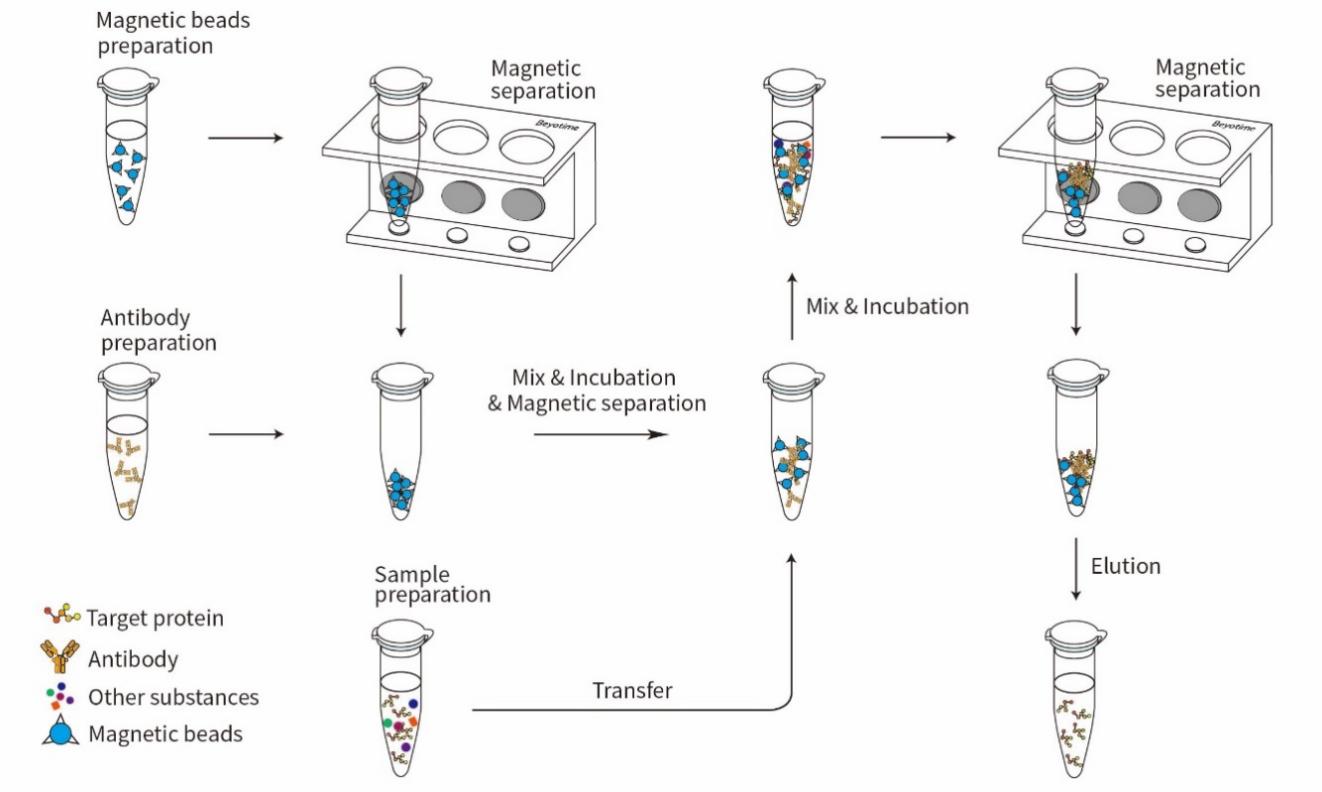
图1.百奥莱博免疫沉淀试剂盒(Protein A+G磁珠法)的免疫沉淀流程图。

本试剂盒提供两种洗脱方法。根据抗体复合物中目的蛋白的结构、生物学功能及后续应用的要求等,本试剂盒提供两种洗脱方法,包括酸性溶液和SDS-PAGE上样缓冲液。如有相应的竞争性多肽,也可自行使用该竞争性多肽进行洗脱。本制品用于GFP-Flag融合蛋白的免疫沉淀效果参考图2。
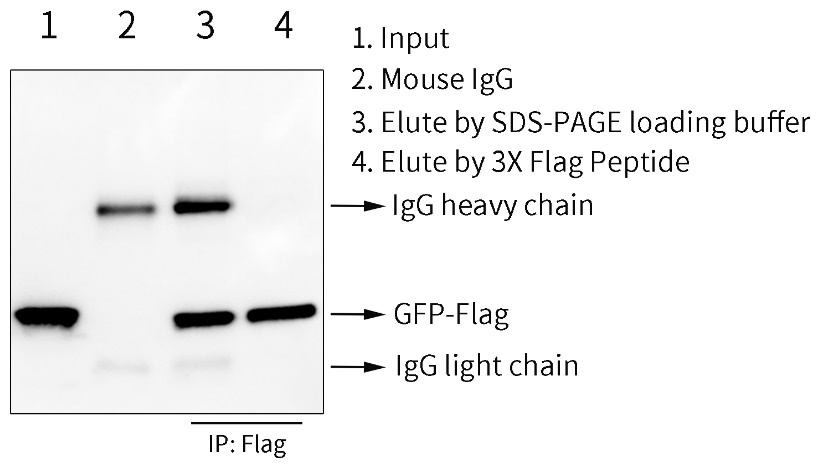
图2.免疫沉淀试剂盒(Protein A+G磁珠法)用于GFP-Flag融合蛋白的免疫沉淀效果图。293T细胞(人胚肾细胞)转染GFP-Flag质粒36小时后,经Lysis Buffer裂解。样品1为Input,即全细胞裂解液;样品2、3和4都为本试剂盒中Protein A+G磁珠免疫沉淀后的样品,其中样品2中使用的是正常的小鼠IgG免疫沉淀后经1×SDS-PAGE Sample Loading Buffer洗脱后得到的样品,为阴性对照;样品3和4进行IP时使用的都是Flag抗体,其中样品3使用1×SDS-PAGE Sample Loading Buffer洗脱,样品4使用3X Flag多肽洗脱。使用1×SDS-PAGE Sample Loading Buffer洗脱后可以检测到Flag抗体的轻重链,而使用3X Flag Peptide洗脱仅含有GFP-Flag,整个泳道仅检测到单一的目的条带。实际结果会因实验条件、检测仪器等的不同而存在差异,图中数据仅供参考。

- 需自备磁分离架。
- 如果免疫沉淀的目的蛋白涉及磷酸化修饰或者乙酰化修饰,需要自备相应的磷酸酶抑制剂和去乙酰化酶抑制剂。推荐选购磷酸酶抑制剂混合物L和去乙酰化酶抑制剂混合物。
- 本试剂盒提供的Lysis Buffer经反复测试,适合很多情况下的免疫沉淀或免疫共沉淀时的样品裂解和后续的洗涤。但由于免疫沉淀或免疫共沉淀蛋白样品的复杂性和特殊性,本Lysis Buffer不一定适合所有免疫沉淀样品的裂解与洗涤。在使用本试剂盒提供的Lysis Buffer效果欠佳的情况下,需要自行对于裂解液和洗涤液进行摸索和调整。此时建议根据文献自行配制裂解液和洗涤液,或尝试百奥莱博的其它适当裂解液。
- BalbMag系列磁珠经测试,反复冻融3次以上,不影响使用效果。
- BalbMag Magnetic Beads需维持pH为6~8,避免高速离心、干燥或冻存;请勿长时间将磁珠置于磁场中,否则可能会引起磁珠聚团。
- BalbMag Magnetic Beads使用前要适当充分重悬,即颠倒若干次使磁珠混合均匀,混匀操作须轻柔,不宜剧烈涡旋震荡等,避免抗体变性等。
- 在免疫沉淀时,建议使用抗体种属相同的正常IgG配制相同稀释比或终浓度的正常IgG工作液,以用于去除非特异性结合或作为阴性对照。本试剂盒中提供适量Normal Mouse IgG和Normal Rabbit IgG,更多需求,可以订购百奥莱博的小鼠IgG、大鼠IgG、兔IgG、山羊IgG、人IgG、驴IgG。
- 蛋白样品收集后宜尽快完成纯化工作,并应始终放置在4℃或冰浴,以减缓蛋白降解或变性。
- 如果使用真空泵等仪器吸取上清液,须注意真空泵的吸液强度,以免吸力过大而吸取到聚集的磁珠。
- 酸性溶液洗脱时磁珠可能会发生聚集,属于正常现象,不影响磁珠的正常使用。0.1%的非离子型去垢剂(如Triton X-100、Tween-20或NP-40)可有效防止磁珠聚集,并且不会影响磁珠的抗体结合效率。

- 试剂盒的准备:
参考下表,按照每个样品使用100~500μL裂解液的比例,准备相关试剂。步骤 所需溶液 用量(100μL) 用量(500μL) 细胞裂解及样品制备 含抑制剂裂解液 100μL 500μL 磁珠制备 TBS ~0.5mL ~1.5mL 免疫沉淀 Magnetic Beads 4μL 20μL 磁珠抗体复合物洗涤(3次) TBS 100μL/次 500μL/次 磁珠抗体抗原复合物洗涤(3次) 含抑制剂裂解液 100μL/次 500μL/次 酸性洗脱与中和(可选) Acid Elution Buffer 20μL 100μL Neutralization Buffer 2μL 10μL SDS‐PAGE洗脱(可选) 1×SDS-PAGE Sample Loading Buffer 20μL 100μL - 含抑制剂裂解液的配制:参考上表,按照每50~100万细胞使用100~200μL含抑制剂裂解液用于裂解以及300~600μL含抑制剂裂解液用于洗涤的比例,配制适量的含抑制剂裂解液。将Lysis Buffer与100×Protease Inhibitor Cocktail按照100:1的比例混合,例如在1mL的Lysis Buffer中加入10μL 100×Protease Inhibitor Cocktail,即得1mL含抑制剂裂解液。配制好的含抑制剂裂解液宜放置在冰浴或4℃。
- 如果免疫沉淀的目的蛋白涉及磷酸化修饰或者乙酰化修饰,需要添加磷酸酶抑制剂或去乙酰化酶抑制剂。推荐使用磷酸酶抑制剂混合物L和去乙酰化酶抑制剂混合物。如果有特殊需求,可考虑选择其它适当的抑制剂混合物。
- Lysis Buffer不仅用于样品裂解,也用于后续的洗涤步骤,请特别注意“注意事项”中的相关描述。
- 含抑制剂裂解液宜现用现配,不宜配制后冻存并留作后续使用。如果有特殊需求,可以尝试百奥莱博的其它多种蛋白酶、磷酸酶和去乙酰化酶抑制剂混合物。
- TBS的配制:将10×TBS用超纯水水稀释至1×,即为TBS。例如1mL 10×TBS加入9mL超纯水,混匀后即为TBS。
- 磁珠的准备:由于磁珠储存在特殊保护液中,所以需要在加入样品前适当洗涤。
- 用移液器轻轻吹打重悬磁珠,按照每500μL样品使用20μL磁珠悬浊液比例,取适量磁珠至一洁净离心管中(货号:YTB8001),加入TBS至最终体积为约0.5mL。
- 如果初始磁珠体积大于0.2mL,可以考虑先直接置于磁力架上分离10秒,去除上清,然后再加入TBS至最终体积为约0.5mL。
- 用移液器轻轻吹打重悬磁珠。置于磁力架上分离10秒,去除上清。重复上述步骤两次。
- 按照初始体积的量,用TBS重悬磁珠。
- 用移液器轻轻吹打重悬磁珠,按照每500μL样品使用20μL磁珠悬浊液比例,取适量磁珠至一洁净离心管中(货号:YTB8001),加入TBS至最终体积为约0.5mL。
- 1×SDS-PAGE Sample Loading Buffer的配制:取适量5×SDS-PAGE Sample Loading Buffer用水稀释5倍即为1×SDS-PAGE Sample Loading Buffer。例如0.2mL 5×SDS-PAGE Sample Loading Buffer加入0.8mL超纯水,混匀后即为1×SDS-PAGE Sample Loading Buffer。
- 含抑制剂裂解液的配制:参考上表,按照每50~100万细胞使用100~200μL含抑制剂裂解液用于裂解以及300~600μL含抑制剂裂解液用于洗涤的比例,配制适量的含抑制剂裂解液。将Lysis Buffer与100×Protease Inhibitor Cocktail按照100:1的比例混合,例如在1mL的Lysis Buffer中加入10μL 100×Protease Inhibitor Cocktail,即得1mL含抑制剂裂解液。配制好的含抑制剂裂解液宜放置在冰浴或4℃。
- 细胞或组织样品的裂解和准备:
样品裂解后宜立即进行后续的免疫沉淀或免疫共沉淀,如果不能立即进行后续的实验,可以-20℃或-80℃冻存,但冻融可能会影响蛋白与蛋白的相互作用。所有的样品裂解步骤宜在冰浴或4℃操作,以尽量减少蛋白降解的可能性。样品准备好后,注意取一定量作为Input或Total,以用于后续的Western等检测。- 悬浮细胞的样品裂解和准备:
250~1000×g室温离心5min收集细胞。如有必要,可以使用PBS洗涤一次,然后吸净残留的液体。轻轻vortex或者弹击管底以把细胞尽量分散开。按照每50~100万细胞加入100~200μL的比例加入含抑制剂裂解液。轻弹管底或适当吹打,以充分裂解细胞。充分裂解后应没有明显的细胞沉淀。如果细胞量较多,建议分装成50~100万细胞/管,然后再裂解。大团的细胞较难裂解充分,而少量的细胞由于裂解液容易和细胞充分接触,相对比较容易裂解充分。充分裂解后,10000~14000×g在4℃离心3~5分钟,取上清,即可进行后续的免疫沉淀和免疫共沉淀等。- 裂解后会出现少量不溶性物质,主要为基因组DNA等,离心后会产生沉淀物。
- 贴壁细胞样品的裂解和准备:
吸除培养液。如有必要,用PBS洗涤一次,然后吸净残留的液体。按照每50~100万细胞(相当于6孔板的一个孔)加入100~200μL的含抑制剂裂解液,适当吹打,使裂解液和细胞充分接触。通常裂解液接触动物细胞1~2秒后,细胞就会被裂解。植物细胞宜在冰上裂解2~10min。充分裂解后,10000~14000×g在4℃离心3~5分钟,取上清,即可进行后续的免疫沉淀和免疫共沉淀等。- 裂解后会出现少量不溶性物质,主要为基因组DNA等,离心后会产生沉淀物。
- 细菌或酵母样品的裂解和准备:
对于1mL菌液或酵母液,离心去上清,如果有必要,可以使用PBS洗涤一次,然后吸净残留的液体。轻轻vortex或者弹击管底以把细菌或酵母尽量分散开。加入100~200μL含抑制剂裂解液,轻轻vortex或者弹击管底以混匀,冰上裂解2~10min。如果希望获得更好的裂解效果,细菌和酵母可以分别使用溶菌酶(lysozyme)和破壁酶(lyticase)消化,然后再使用含抑制剂裂解液进行裂解。充分裂解后,10000~14000×g在4℃离心3~5分钟,取上清,即可进行后续的免疫沉淀和免疫共沉淀等。- 裂解后很可能会出现少量不溶性物质,主要为基因组DNA等,离心后会产生沉淀物。
- 组织样品的裂解和准备:
- 把组织剪切成细小的碎片。如果组织样品本身非常细小,也可以不再进行剪切。
- 按照每10~20mg组织使用100~200μL的比例加入含抑制剂裂解液。如果裂解不充分可以使用更多的含抑制剂裂解液,如果需要高浓度的蛋白样品,可以适当减少裂解液的用量。
- 用玻璃匀浆器匀浆,或使用手持式组织研磨仪研磨,直至充分裂解。也可以把组织样品冷冻后液氮研磨,研磨充分后加入裂解与洗涤液进行裂解。
- 充分裂解后,10000~14000×g在4℃离心3~5分钟,取上清,即可进行后续的免疫沉淀和免疫共沉淀等。每20mg冻存的小鼠肝脏组织用200μL含抑制剂裂解液裂解后获得的上清,其蛋白浓度约为15~25mg/mL,不同状态的不同组织有所不同。
- 裂解后很可能会出现少量不溶性物质,主要为基因组DNA等,离心后会产生沉淀物。
- 把组织剪切成细小的碎片。如果组织样品本身非常细小,也可以不再进行剪切。
- 悬浮细胞的样品裂解和准备:
- 抗体与Protein A+G磁珠的结合:
- 抗体的准备:按抗体使用说明中推荐的稀释比例用TBS稀释抗体,配制成抗体工作液;或将抗体配制成终浓度5~50μg/mL的抗体工作液。置于冰上备用。可选做:使用抗体种属相同的正常IgG配制相同稀释比或终浓度的正常IgG工作液,以用于去除非特异性结合或作为阴性对照。所谓种属相同的正常IgG是指,例如后续免疫沉淀时用的抗体是小鼠IgG,则在本步骤中可以用TBS稀释适量的Normal Mouse IgG等以用于降低背景或作为阴性对照。
- 抗体吸附:将在步骤1中准备好的Protein A+G磁珠进行磁性分离,吸除上清,加入500μL抗体工作液或正常IgG工作液,重悬后在室温翻转混合仪上翻转孵育15分钟~1小时。
- 也可以直接在步骤1磁珠的准备步骤,向Protein A+G磁珠中加入适量抗体或正常IgG进行孵育。
- 洗涤:加入500μL的TBS,用移液器轻轻吹打重悬Protein A+G磁珠。置于磁力架上分离10秒,去除上清。重复洗涤三次。按照初始体积的量,用TBS重悬Protein A+G磁珠。
- 孵育和洗涤过程中,如果磁珠发生聚团或呈片状属正常现象,不会影响实验结果。
- 抗体的准备:按抗体使用说明中推荐的稀释比例用TBS稀释抗体,配制成抗体工作液;或将抗体配制成终浓度5~50μg/mL的抗体工作液。置于冰上备用。可选做:使用抗体种属相同的正常IgG配制相同稀释比或终浓度的正常IgG工作液,以用于去除非特异性结合或作为阴性对照。所谓种属相同的正常IgG是指,例如后续免疫沉淀时用的抗体是小鼠IgG,则在本步骤中可以用TBS稀释适量的Normal Mouse IgG等以用于降低背景或作为阴性对照。
- 免疫沉淀(IP):
- 去除非特异性结合(可选做):步骤3中准备的结合了正常IgG的Protein A+G磁珠与样品4℃孵育1小时后磁性分离,上清样品用于后续实验。本实验步骤的目的是去除与正常IgG产生非特异性结合的蛋白。
- 样品与结合了抗体或正常IgG的Protein A+G磁珠孵育:按照每500μL蛋白样品加入20μL磁珠悬浊液的比例加入结合了抗体或正常IgG的Protein A+G磁珠,置于侧摆摇床或旋转混合仪上,室温孵育2小时或4℃孵育过夜。
- 孵育过程中,如果磁珠发生聚团或呈片状属正常现象,不会影响实验结果。
- 也可先将适量抗体或正常IgG与样品室温孵育1~2小时或4℃孵育过夜后,再加入10~20μL磁珠悬浊液室温孵育1小时。具体见常见问题2。
- 磁分离:孵育完毕后,置于磁力架上分离10秒,去除上清。
- 可保留部分上清液,用于检测免疫沉淀的效果。
- 洗涤:加入0.5mL的含抑制剂裂解液,用移液器轻轻吹打重悬磁珠。置于磁力架上分离10秒,去除上清。重复使用含抑制剂裂解液洗涤三次。
- 也可以通过检测洗涤得到的液体的OD280来判断是否洗涤完全,若OD280大于0.05,应适当增加洗涤次数。
- 去除非特异性结合(可选做):步骤3中准备的结合了正常IgG的Protein A+G磁珠与样品4℃孵育1小时后磁性分离,上清样品用于后续实验。本实验步骤的目的是去除与正常IgG产生非特异性结合的蛋白。
- 洗脱:
根据标签蛋白的特点及后续实验要求,可以选择如下3种方法之一进行洗脱。- 酸性洗脱法:
本方法为非变性法,比较快速高效。洗脱后的蛋白很多情况下能保持原有的生物活性,便于后续分析检测。- 每20μL原始磁珠体积,加入100μL Acid Elution Buffer (酸性洗脱液),混匀后置于侧摆摇床或旋转混合仪上,室温孵育5分钟。
- 孵育时间不宜超过15分钟。
- 孵育完毕后,置于磁力架上分离10秒,将上清转移到新的离心管中,并立刻加入10μL Neutralization Buffer (中和液),适当混匀。
- 须立刻加入中和液并混匀,否则长时间处于酸性洗脱液中会容易导致一些蛋白失去活性。
- 为了获得最大的洗脱效率,可重复步骤a和b,并将相同样品合并。
- 洗脱并中和的Flag标签蛋白及其复合物置于4℃待用,或者-20℃或-80℃长期保存。
- 酸性洗脱法虽然高效,但仍可能低于竞争洗脱法或SDS-PAGE上样缓冲液洗脱法。
- 由于目的蛋白的差异可能对酸性洗脱法的洗脱效率有一定的影响,如果对洗脱效率的要求比较高,可对酸性洗脱液的pH在2.5~3.1之间进行一定的调整,相应的中和液的pH值或量也要进行一定的调整,具体需要自行优化相关实验条件。也可以考虑采用效率可能更高的多肽竞争洗脱法或效率预期最高的SDS-PAGE上样缓冲液洗脱法,后者的缺点是在变性条件下进行洗脱,可能会对后续的对于蛋白活性有要求的实验产生影响。
- 每20μL原始磁珠体积,加入100μL Acid Elution Buffer (酸性洗脱液),混匀后置于侧摆摇床或旋转混合仪上,室温孵育5分钟。
- SDS-PAGE上样缓冲液洗脱法:
本方法为变性法,得到的蛋白样品适合SDS-PAGE电泳或Western检测。- 每20μL原始磁珠体积的磁珠,加入100μL 1×SDS-PAGE Sample Loading Buffer,95℃加热5分钟。
- 置于磁力架上分离10秒,取上清即可用于SDS-PAGE电泳或Western检测。
- 通常SDS-PAGE蛋白上样缓冲液含有DTT等还原剂,其洗脱得到的蛋白样品中会含有抗体的轻链和重链。
- 其它SDS-PAGE上样缓冲液可以考虑选择2×SDS-PAGE蛋白上样缓冲液、5×SDS-PAGE蛋白上样缓冲液、6×SDS-PAGE蛋白上样缓冲液。
- 每20μL原始磁珠体积的磁珠,加入100μL 1×SDS-PAGE Sample Loading Buffer,95℃加热5分钟。
- 多肽竞争洗脱法:
如果目的蛋白是标签蛋白,并使用相应的标签抗体进行免疫沉淀,则可使用相应的多肽进行竞争洗脱。本方法为非变性法,洗脱效率高,且洗脱后的蛋白保持原有的生物活性,便于后续分析检测。以下以Flag标签蛋白为例:- 3X Flag多肽洗脱液的配制:取适量3X Flag多肽溶解于TBS中,使其终浓度为150μg/mL,或稀释5mg/mL的3X Flag多肽至150μg/mL。
- 每20μL原始磁珠体积,加入100μL 3X Flag多肽洗脱液(150μg/mL),混匀后置于侧摆摇床或旋转混合仪上,室温摇晃孵育30~60分钟,或4℃孵育1~2小时。为了提高洗脱效率,可延长孵育时间或重复洗脱。
- 孵育完毕后,置于磁力架上分离10秒,将上清转移到新的离心管中。上清即为洗脱的Flag标签蛋白。
- 洗脱的Flag标签蛋白置于4℃待用,或者-20℃或-80℃长期保存。
- 3X Flag多肽洗脱液的配制:取适量3X Flag多肽溶解于TBS中,使其终浓度为150μg/mL,或稀释5mg/mL的3X Flag多肽至150μg/mL。
- 酸性洗脱法:

- 如何提高抗体与磁珠结合效率?
磁珠与抗体的结合效率与抗体的种属来源及所属亚型有关,如抗体所属亚型与Protein A、G或A/G的亲和力较低,可以通过增加抗体与磁珠的孵育时间、提高TBS的pH值(8-9)或降低离子强度(25~100mM NaCl)等方法提高亲和力。 - 如何提高磁珠在免疫沉淀或免疫共沉淀反应中的特异性?
- 参考步骤4b中的备注,可以先将适量抗体与样品进行孵育,形成抗体-抗原复合物,再用Protein A、G或A/G磁珠捕获复合物,这样可以提高抗体与抗原的结合效率,并降低磁珠与样品接触的时间,从而提高沉淀产物的特异性。对于蛋白质/核酸共沉淀或染色质免疫共沉淀也推荐使用此方法。
- 参考步骤4a,使用结合了正常IgG的磁珠与蛋白样品预孵育,可以减少抗体的非特异性结合。类似地,也可以在蛋白样品中先加入正常IgG预孵育,然后再加入抗体进行孵育,随后再加入磁珠进行抗体的免疫沉淀。
- 设置正常IgG作为抗体的对照,可以确定免疫沉淀或免疫共沉淀产物的特异性。
- 参考步骤4b中的备注,可以先将适量抗体与样品进行孵育,形成抗体-抗原复合物,再用Protein A、G或A/G磁珠捕获复合物,这样可以提高抗体与抗原的结合效率,并降低磁珠与样品接触的时间,从而提高沉淀产物的特异性。对于蛋白质/核酸共沉淀或染色质免疫共沉淀也推荐使用此方法。
- 如何避免磁珠在储存或使用过程中可能出现的聚集情况?
磁珠通常应保存在2~8℃,使用时应避免由于污染而导致的不可逆聚集,或因干燥而导致的聚集。磁珠在低pH的洗脱缓冲液中发生聚集属于正常现象,不影响磁珠的正常使用。在TBS和洗脱缓冲液中添加终浓度为0.1% (v/v)的非离子型去垢剂,如Triton X-100、Tween-20或NP-40,可有效防止磁珠聚集。经过低pH洗脱操作的磁珠可以用TBS洗涤至中性,然后用含有0.1% (v/v) Tween-20的TBS振荡重悬磁珠,并用超声波水浴处理2分钟,即可使磁珠恢复均匀状态,以上处理均不影响磁珠的抗体结合效率。 - 如何解决磁珠易粘附在离心管等耗材表面的现象?
建议使用低吸附率的耗材进行磁珠操作。另外,在缓冲液中添加0.1% (v/v)的非离子型去垢剂(如Triton X-100、Tween-20或NP-40)可以有效降低磁珠在耗材表面的粘附。 - 磁珠在使用过程中出现结块现象?
磁珠在使用时如果出现结块现象,容易导致分布不均。出现该问题的原因是磁珠在磁场中放置太久而使磁珠牢固的结合在一起。用超声波水浴处理2分钟即可打散磁珠使其重新分散,但应注意超声处理也会使磁珠在样品溶液中捕获的抗体脱落,所以磁珠在加样后洗脱前不宜使用该方法处理磁珠的结块问题。

Protein A+G磁珠适合于免疫沉淀所有Protein A磁珠和Protein G磁珠单独可以免疫沉淀的抗体,包括human IgG1、IgG2、IgG3、IgG4,mouse IgG1、IgG2a、IgG2b、IgG3,rat IgG1、IgG2a、IgG2b、IgG2c,以及rabbit、goat等多克隆抗体。下表是百奥莱博Protein A、Protein G、Protein A/G磁珠产品与人、小鼠、大鼠常见的免疫球蛋白亚类的结合能力及不同物种的总结合能力情况表。
|
++++,Strong Binding ++~+++,Medium Binding +,Weak Binding +/-,Weak or No Binding -,No Binding |
相关搜索:磁珠法免疫沉淀试剂盒(Protein A+G),磁珠法免疫沉淀,Protein A+G磁珠,IP Kit with Protein A+G Magnetic Beads



